
แนวคิดในการพัฒนาแบบจำลองอะตอม
ในสมัยโบราณมีนักปราชญ์ชาวกรีกชื่อ ดิโคริตุส (Democritus) เชื่อว่าเมื่อย่อยสารลงเรื่ออย ๆ จะได้ส่วนที่เล็กที่สุดซึ่งไม่สามารถทำให้เล็กลงกว่าเดิมได้อีก และเรียกอนุภาคขนาดเล็กที่สุดว่า อะตอม ซึ่งคำว่า "อะตอม"(atom) เป็นคำซึ่งมาจากภาษากรีกว่า (atomas) แปลว่า แบ่งแยกอีกไม่ได้
 อะตอม คือหน่วยที่เล็กที่สุดของสสารที่ยังคงสภาพความเป็นสสารอยู่ได้
อะตอม คือหน่วยที่เล็กที่สุดของสสารที่ยังคงสภาพความเป็นสสารอยู่ได้
แบบจำลองอะตอม ตามทฤษฏี มีอยู่ 5 แบบ คือ
1. แบบจำลองอะตอมของดอลตัน
สสารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุดเรียกว่า อะตอม
ซึ่งไม่สามารถแบ่งแยกต่อไปได้อีก
ดอลตันเป็นนักเคมีคนแรกที่เสนอแนวคิดเกี่ยวกับอะตอม ซึ่งมีสาระสำคัญดังนี้
- ธาตุประกอบด้วยอนุภาคเล็ก ๆ หลายอนุภาค อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้สูญหายหรือสร้างขึ้นใหม่ไม่ได้
- อะตอมของธาตุชนิดเดียวกันย่อมมีสมบัติเหมือนกัน มีมวลเท่าๆ กัน แต่มีสมบัติแตกต่างจากอะตอมของธาตุอื่น ๆ
- สารประกอบเกิดจากอะตอมของธาตุมากกว่า 1 ชนิด ทำปฏิกิริยากันในอัตราส่วนที่เป็นเลขลงตัวอย่างง่าย
2. แบบจำลองอะตอมของทอมสัน
อะตอม ประกอบด้วย อนุภาคโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับประจุลบ
สรุปแบบจำลองอะตอมของทอมสัน
อะตอมมีลักษณะเป็นทรงกลุม มีอนุภาคที่มีประจุบวก เรียกว่า โปรตอน อนุภาคที่มีประจุลบ เรียกว่า อิเล็กตรอน และจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนกระจายอยู่ทั่วไปในทรงกลม
อะตอมมีลักษณะเป็นทรงกลุม มีอนุภาคที่มีประจุบวก เรียกว่า โปรตอน อนุภาคที่มีประจุลบ เรียกว่า อิเล็กตรอน และจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนกระจายอยู่ทั่วไปในทรงกลม
ออยแกน โกลด์สไตน์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองโดยใช้หลอดรังสีแคโทด พบว่า อนุภาคบวก มีค่าอัตราส่วนประจุต่อมวลไม่คงที่ ขึ้นอยู่กับชนิดของก๊าซ และอนุภาคบวกที่เกิดจากไฮโดรเจน เรียกว่า โปรตอน
3. แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอม ประกอบด้วย นิวเคลียสที่มีโปรตอนรวมอยู่ตรงกลาง มีขนาดเล็ก และมีมวลมาก และมีอิเล็กตรอนซึ่งมีมวลน้อยวิ่งอยู่รอบ ๆ นิวเคลียส
ลอร์อเออร์เนสต์ รัทเทอร์ฟอร์ด นักวิทยาศาสตร์ชาวอังกฤษ และฮันส์ ไกเกอร์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองยิงอนุภาคแอลฟาไปยังแผ่นทองคำบาง ๆ เรียกการทดลองนี้ว่าการทดลองการกระเจิงรังสีอัลฟาของรัทเทอร์ฟอร์ด

จากการทดอลองพบว่า
- อนุภาคแอลฟาส่วนใหญ่วิ่งเป็นแนวเส้นตรงทะลุแผ่นทองคำบาง ๆ
- อนุภาคแอลฟาบางส่วนวิ่งเบี่ยงเบนไปจากแนวเส้นตรง
- อนุภาคแอลฟาส่วนน้อยสะท้อนกลับ
ดังนั้นรัทเทอร์ฟอร์ด เชื่อว่า น่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ภายในนิวเคลียส ซึ่งไม่มีประจุ แต่มีมวลใกล้เคียงกับโปรตอน
4. แบบจำลองอะตอมของนีลส์ โบร์
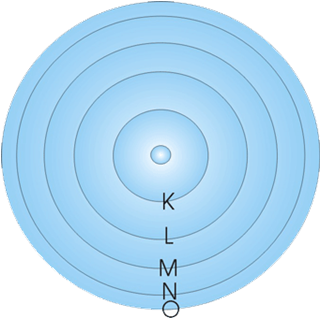
นีลส์ โบร์ นักวิทยาศาสตร์ชาวเดนมาร์ก ได้ทำการศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน และได้สร้างแบบจำลองอะตอมเพื่อใช้อธิบายลักษณะการเคลื่อนที่ของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว และเรียกระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุด ซึ่งมีระดับพลังงานต่ำที่สุด เรียกว่า ระดับพลังงาน K และเรียกระดับพลังงานถัดออกมาว่า ระดับพลังงาน L,M,N,... ตามลำดับ
5. แบบจำลองอะตอมของกลุ่มหมอก
(7).jpg)
(7).jpg)
อะตอมจะประกอบด้วย กลุ่มหมอกของอิเล็กตรอนรอบ ๆ นิวเคลียส โดยมีทิศทางไม่แน่นอน โอกาสที่จะพบอิเล็กตรอนบริเวณใกล้นิวเคลียสมีมากกว่าบริเวณที่อยู่ห่างจากนิวเคลียส
เนื่องจากแบบจำลองอะตอมของโบร์ใช้อธิบายได้ดีเฉพาะธาตุไฮโรเจนซึ่งมีอิเล็กตรอนเพียงตัวเดียว ดังนั้นถ้าธาตุมีหลายอิเล็กตรอน ทฤษฏีของโบร์ไม่สามารถอธิบายได้ นักวิทยาศาสตร์จึงค้นคว้า ทดลองจนเกิดเป็นแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีลักษณะดังนี้
- อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสด้วยความเร็วสูง วงโคจรไม่จำเป็นต้องเป็นวงกลมเสมอ
- ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้
- บริเวณกลุ่มหมอกหนาทึบ แสดงว่ามีโอกาสพบอิเล็กตรอนบริเวณนั้นมาก และบริเวณที่กลุ่มหมอกจาง แสดงว่ามีโอกาสพบอิเล็กตรอนน้อย
การจัดเรียงอิเล็กตรอนในอะตอม
จากการศึกษาแบบจำลองอะตอมโดยใช้สมการทางคณิตศาสตร์ขั้นสูงที่เรียกว่าสมการคลื่น คำนวณหาค่าพลังงานอิเล็กตรอน ทำให้ทราบว่าอะตอมประกอบด้วยโปรตอนและนิวตรอนอยู่รวมกันในนิวเคลียส โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบ ๆ และอยู่ในระดับพลังงานต่างกัน อิเล็กตรอนเหล่านั้นอยู่กันอย่างไร ในแต่ละระดับพลังงานจะมีจำนวนอิเล็กตรอนสูงสุดเท่าใด ให้นักเรียนพิจารณาข้อมูลจากตารางแสดงการจัดเรียงอิเล็กตรอนของธาตุบางธาตุ ดังตาราง 1.4
ตาราง แสดงการจัดอิเล็กตรอนของธาตุบางธาตุ
| ||||||||||||||||
เมื่อพิจารณาข้อมูลในตาราง 1.4 จะพบว่าจำนวนอิเล็กตรอนในระดับพลังงานที่ 1 มีได้มากที่สุด 2 อิเล็กตรอน ระดับพลังงานที่ 2 มีได้มากที่สุด 2 อิเล็กตรอน สำหรับระดับพลังงานที่ 3 นั้น จากการสืบค้นข้อมูลเพิ่มเติมทำให้ทราบว่ามีได้มากที่สุด 18 อิเล็กตรอน นั่นคือ แต่ละระดับพลังงานมีอิเล็กตรอนสูงสุด = 2n2 กำหนดให้ n = ระดับพลังงานของอิเล็กตรอน ดังตาราง 1.5
ตารางแสดงการบรรจุอิเล็กตรอนในระดับพลังงานหลัก
ระดับพลังงานที่ (n)
|
1
|
2
|
3
|
4
|
5
|
6
|
จำนวนอิเล็กตรอนที่มีได้มากที่สุด (2n2)
|
2
|
8
|
18
|
32
|
32
|
32
|
จากตารางจะเห็นว่า สูตร 2n2 ใช้ได้ไม่เกินระดับพลังงานที่ n = 4
หลักเกณฑ์ในการจัดอิเล็กตรอนเข้าสู่ระดับพลังงานหลักของอะตอม
1. ต้องทราบว่าอะตอมของธาตุนั้นมีอิเล็กตรอนกี่อิเล็กตรอน โดยหาจากเลขอะตอม(Z)
2. ต้องจัดอิเล็กตรอนเข้าไปในระดับพลังงานที่ n = 1 ให้เต็มก่อน เมื่อเต็มแล้วจึงจัดเข้าสู่ระดับพลังงาน n = 2 n = 3 ไปตามลำดับ โดยจำนวนอิเล็กตรอนที่มีได้มากที่สุดในแต่ละระดับพลังงานเท่ากับ 2n2 แต่ระดับพลังงานไม่เกิน n = 43. จำนวนอิเล็กตรอนในระดับพลังงานนอกสุดมีได้ไม่เกิน 8 อิเล็กตรอน และเรียกอิเล็กตรอนที่อยู่ชั้นนอกสุดนี้ว่า เวเลนซ์อิเล็กตรอน
4. จำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ระดับพลังงานของอะตอมมีได้ไม่เกิน 18 อิเล็กตรอน
ความสัมพันธ์ระหว่างระดับพลังงานหลักกับระดับพลังงานย่อย | ||||||||||||||||||
| ||||||||||||||||||
จากตารางได้ข้อสังเกตว่า
1. ระดับพลังงานหลัก n = 1 มีเฉพาะระดับพลังงานย่อย s
ระดับพลังงานหลัก n = 2 มีเฉพาะระดับพลังงานย่อย s, p
ระดับพลังงานหลัก n = 3 มีเฉพาะระดับพลังงานย่อย s, p, d
ระดับพลังงานหลัก n = 4 มีเฉพาะระดับพลังงานย่อย s, p, d, f
2. ในระดับพลังงานย่อยจะมีตัวเลขข้างหน้าบอกระดับพลังงานหลัก ส่วนตัวเลขยกกำลังมุมขวาบนบอกจำนวนอิเล็กตรอนที่บรรจุได้สูงสุด เช่น
4p6 หมายความว่าระดับพลังงานหลัก n = 4 ในระดับพลังงานย่อย p-orbital มี 6 อิเล็กตรอน
4d5 หมายความว่าระดับพลังงานหลัก n = 4 ในระดับพลังงานย่อย d-orbital มี 5 อิเล็กตรอน
|
จากการเรียงอิเล็กตรอนของธาตุในระดับพลังงานหลักทำให้ทราบว่า
1. จำนวนระดับพลังงานหลักของอิเล็กตรอน ทำให้ทราบว่าธาตุนั้นอยู่คาบใด ถ้าธาตุมีจำนวนระดับพลังงานของอิเล็กตรอนเท่ากัน แสดงว่าธาตุนั้นอยู่ในคาบเดียวกัน เช่นMg มีเลขอะตอม 12 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8, 2 Mg มี 3 ระดับพลังงานS มีเลขอะตอม 16 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8, 6 S มี 3 ระดับพลังงาน
แสดงว่า Mg และ S อยู่ในคาบเดียวกัน
แสดงว่า Mg และ S อยู่ในคาบเดียวกัน
2. จำนวนเวเลนซ์อิเล็กตรอน หรืออิเล็กตรอนที่อยู่ในระดับพลังงานนอกสุด ทำให้ทราบหมู่ของธาตุ ถ้าธาตุมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากัน แสดงว่าธาตุนั้นอยู่ในหมู่เดียวกัน เช่น Na มีเลขอะตอม 11 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8, 1 Naมีเวเลนซ์อิเล็กตรอนเท่ากับ 1
K มีเลขอะตอม 19 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8,8, 1 K มีเวเลนซ์อิเล็กตรอนเท่ากับ 1 แสดงว่า ธาตุ Na และ K อยู่ในหมู่เดียวกัน
K มีเลขอะตอม 19 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8,8, 1 K มีเวเลนซ์อิเล็กตรอนเท่ากับ 1 แสดงว่า ธาตุ Na และ K อยู่ในหมู่เดียวกัน
การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
การจัดอิเล็กตรอนในระดับพลังงานหลัก ทำให้แต่ละระดับพลังงานมีจำนวนอิเล็กตรอนมากจึงเกิดปัญหาว่าอิเล็กตรอนเหล่านั้นอยู่ในระดับพลังงานเดียวกันได้อย่างไร ทำไมจึงไม่ผลักกัน เพื่อแก้ปัญหาดังกล่าว นักวิทยาศาสตร์จึงได้ศึกษาเกี่ยวกับระดับพลังงานย่อยเพื่อกระจายอิเล็กตรอนในแต่ละระดับพลังงานหลัก เข้าสู่ระดับพลังงานย่อย โดยอาศัยรูปแบบโคจรของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นเกณฑ์ในการแบ่งอิเล็กตรอนเป็นกลุ่มย่อย ๆ และเรียกรูปแบบวงโคจรนี้ว่าออร์บิทัล (Orbital) โดย 1 ออร์บิทัลจะมีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน ระดับพลังงานย่อยมี 4 ระดับ คือ s, p, d, f โดยระดับพลังงานย่อยมี


s มี 1 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 2 อิเล็กตรอน
p มี 3 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 6 อิเล็กตรอน
d มี 5 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 10 อิเล็กตรอน
f มี 7 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 14 อิเล็กตรอน

การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
1. จัดอิเล็กตรอนในระดับพลังงานย่อยต่าง ๆ จะต้องจัดเข้าในระดับพลังงานย่อยที่มีพลังงานต่ำสุดก่อนแล้วจึงจัดเข้าสู่ระดับพลังงานย่อยที่มีพลังงานสูงขึ้น(ตามหลักของเอาฟบาว) ดังแผนผังต่อไปนี้
|
 |
จากแผนภาพจัดเรียงอิเล็กตรอนเข้าสู่ระดับพลังงานย่อยได้ดังนี้1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
เช่น 17Cl มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย1s2 2s2 2p6 3s2 3p5
21Se มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย1s2 2s2 2p6 3s2 3p6 4s2 3d1
2. อิเล็กตรอน 2 ตัว ที่อยู่ในออร์บิทัลเดียวกัน จะต้องมีทิศทางการเคลื่อนที่สวนทางกันโดยแสดงทิศทางด้วยลูกศร ตามหลักการของเพาลี
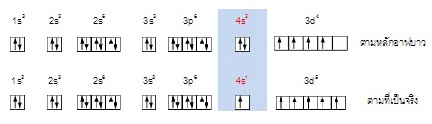
29Cu มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย ดังนี้
เพราะโครงสร้างแบบแรกเสถียรกว่า เพราะ 4s และ 3d จะบรรจุกึ่งหนึ่ง หรือเขียนโครงสร้างของอิเล็กตรอนแบบย่อ ๆ ได้ว่า (Ar) 4s1 3d10
 |
ข้อสังเกตที่ได้จากการใช้จัดเรียงอิเล็กตรอนในอะตอม
1. เลขอะตอมคู่จะอยู่ในหมู่คู่ เลขอะตอมคี่จะเป็นธาตุในหมู่คี่ เช่น
ธาตุ 14Si จะเป็นธาตุในหมู่ 4
ธาตุ 11Na จะเป็นธาตุในหมู่ 1
2. ธาตุหมู่ IA และ IIA ตั้งแต่คาบ 3 ขึ้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 8 เสมอ เช่น
11Na จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 1 12Mg จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 2
19K จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 8, 1 20Ca จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 8, 2
3. ธาตุหมู่ IIIA ถึง VIIIA ตั้งแต่หมู่ที่ IIIA คาบ 4 เป็นต้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 18 เสมอ เช่น
31Ga 2, 8, 18, 3 (หมู่ 3 คาบ 4)
33As 2, 8, 18, 5 (หมู่ 5 คาบ 4)
4. ถ้าธาตุนั้นมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามข้อ 2 และ 3 คือมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้น มีค่าตั้งแต่ 9 – 18 แต่วงนอกสุดมีเวเลนซ์อิเล็กตรอนเป็น 1 หรือ 2 นักเรียนก็ทำนายได้ทันทีว่าเป็นธาตุแทรนซิชัน เช่น
29Cu 2, 8, 18, 1 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียงอิเล็กตรอนเป็น 2, 8,18, 1
23V 2, 8, 8, 5 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียงอิเล็กตรอนเป็น 2, 8,11, 2
หมายเหตุ ธาตุแทรนซิชันที่มีเลขอะตอมตั้งแต่ 21 – 30 จะมีเวเลนซ์อิเล็กตรอนเป็น 2 ยกเว้น Cu กับ Cr จะมีเวเลนซ์อิเล็กตรอนเป็น1



ไม่มีความคิดเห็น:
แสดงความคิดเห็น